Retiran del mercado en EE. UU. más de 140,000 frascos de Atorvastatina por fallas en su disolución
Salud24/10/2025 Celia Santana
Celia Santana
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ordenó el retiro de más de 140, 000 botellas de Atorvastatina Cálcica, medicamento utilizado para reducir el colesterol, tras detectar fallas en los estándares de disolución durante los controles de calidad. El retiro afecta a varios lotes fabricados por Alkem Laboratories y distribuidos por Ascend Laboratories LLC, en presentaciones de 10 mg, 20 mg, 40 mg y 80 mg, con fechas de vencimiento entre julio de 2026 y febrero de 2027.
Según el informe de la FDA, los lotes retirados no cumplieron con las especificaciones de disolución, un parámetro clave que garantiza que el organismo absorba correctamente el principio activo del medicamento. El retiro fue clasificado como Clase II, lo que significa que el uso del producto puede causar consecuencias adversas temporales o médicamente reversibles, pero es poco probable que provoque daños graves.
Qué lotes y presentaciones fueron afectados
De acuerdo con la notificación publicada en el portal de la FDA, el retiro incluye ocho lotes de frascos de 90,500 y 1,000 tabletas de Atorvastatina Cálcica. Los consumidores pueden consultar los números de lote específicos en fda.gov para verificar si sus medicamentos están dentro del retiro.
La principal preocupación es que la disolución inadecuada del medicamento podría impedir la correcta absorción del principio activo, afectando el control de los niveles de colesterol. Esto podría incrementar el riesgo de problemas cardiovasculares en personas vulnerables. Hasta la fecha, no se han reportado efectos adversos graves, pero las autoridades recomiendan no suspender el tratamiento por cuenta propia y consultar con el médico o farmacéutico si se sospecha que el medicamento pertenece a los lotes retirados.
Qué deben hacer pacientes y farmacias
La FDA y las compañías involucradas pidieron a pacientes, médicos y farmacias revisar los números de lote y suspender la dispensación de productos afectados, contactar al distribuidor o fabricante si se identifica algún lote retirado, orientar a los pacientes sobre alternativas terapéuticas seguras y reportar cualquier reacción adversa mediante los canales oficiales de la FDA.
Con información de Infobae.



Hamás acuerda traspasar el Gobierno de Gaza a un comité palestino tecnócrata



SISALRIL registró más de 11 mil personas con cáncer de mama durante el 2024



Salud Pública y SNS aseguran que 2025 ha transcurrido sin muertes por dengue


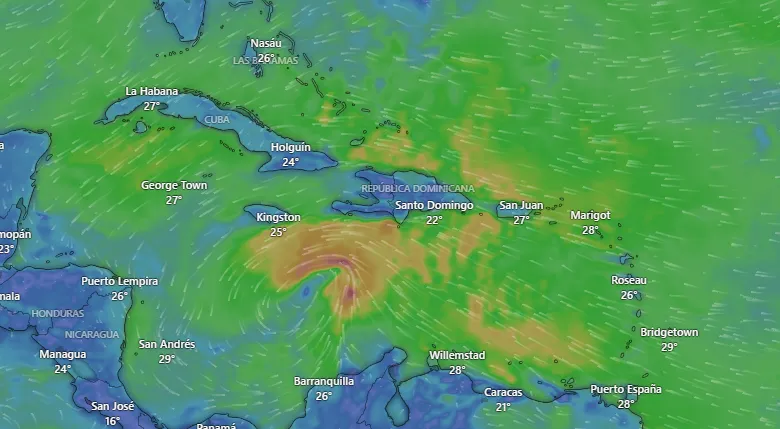

En alerta PR, Cuba, Haití y RD tras fortalecimiento de tormenta tropical Melissa







